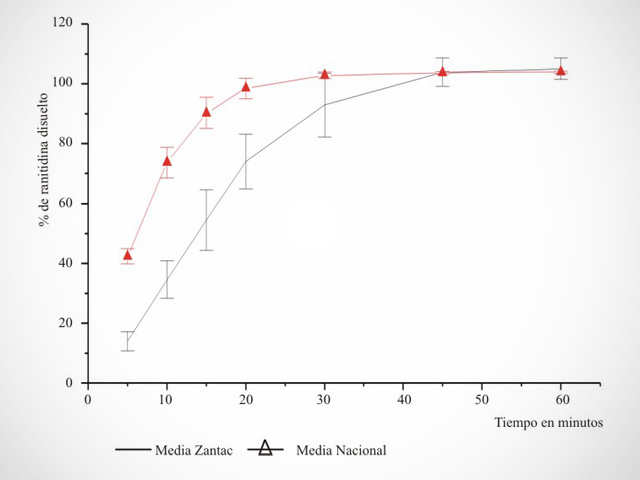
En virtud de las normativas que se estarán implementando próximamente, será requisito de la A.N.M.A.T. que los laboratorios titulares de especialidades medicinales que contengan entre sus principios activos a los ingredientes farmacéuticos categorizados como de riesgo intermedio de acuerdo a Disposición N° 3185/99 realicen los estudios de Equivalencia In Vivo o In Vitro, según corresponda, de conformidad a lo establecido por las Disposiciones (ANMAT) Nº 3185/99, Nº 5330/97, Nº 5040/06, Nº 17406/07 y Nº 758/09.
FP Clinical Pharma -con sus especialistas en Biofarmacia, Biodisponibilidad y Bioequivalencia- pone a disposición de los colegas de la Industria Farmacéutica el asesoramiento y soporte para dar respuesta a las exigencias de las nuevas normativas. Ofrecemos el desarrollo de planes estratégicos y seguimiento para la presentación de protocolos y resultados de bioexención. Consiste en un servicio integral adaptado y flexible a las características de cada producto y a las necesidades de cada laboratorio:
- Evaluación y Desarrollo de Estrategias para Solicitud de Bioexenciones.
- Preparación de Protocolos de Bioexención.
- Gestión y Seguimiento de Ensayos de Permeabilidad.
- Gestión y Seguimiento de Ensayos de Solubilidad.
- Gestión y Seguimiento de Estudios de Cinética de Disolución.
- Soporte de Farmacocinética para Definición de Permeabilidad.
- Análisis de Interacciones APIs- Excipientes- Absorción In Vivo (PK).
- Simulaciones Computacionales de Ensayos In Vivo.
- Bibliografía de Soporte para Bioexenciones.
- Redacción Científica para Soporte de Bioexenciones.
- Preparación de Dossier de Resultados.
- Análisis de Relación In Vitro/ In Vivo.
- Análisis de Riesgo.
La Compañía de Investigación Clínica-Farmacocinética de referencia en la Argentina.